LES ÉCHANTILLONS PEUVENT ÊTRE DIFFICILES, MAIS LA MESURE PEUT ÊTRE FACILE.
La valeur du pH est un paramètre crucial pour de nombreuses applications.
C’est un paramètre fondamental dans l’industrie alimentaire, pour optimiser le nickelage ou le cuivrage, pour assurer des conditions optimales pour une croissance saine des plantes et bien d’autres.
La raison en est que la valeur du pH affecte de nombreux processus biologiques et chimiques tels que la prolifération/survie des micro-organismes, l’activité des enzymes, les réactions chimiques et les équilibres, la solubilité des sels, etc.
Le plus souvent (et aussi le plus précisément), la valeur du pH est mesurée par un pH-mètre avec une électrode en verre. Recevoir des valeurs correctes et stables peut cependant être difficile, en particulier dans certains échantillons (comme les aliments, le sol, les crèmes, la peinture, les échantillons à pH élevé, etc.).
Il est important de comprendre ce que signifie pH, comment fonctionne une électrode de pH et aussi comment la mesure peut être plus facile en utilisant la bonne électrode.
Hanna Instruments est l'un des principaux fabricants d'électrodes de pH et propose une grande variété d'électrodes conçues pour des applications spécifiques.
Industrie pétrochimique
Électrodes photométriques Hanna à utiliser avec nos
titreurs potentiométriques automatiques
1. Qu'est-ce que le pH ?
La valeur du pH est une mesure du nombre d’ions hydrogène actifs présents dans un échantillon. En pratique, la concertation est plus souvent utilisée que l’activité.
En termes plus simples, le pH est une mesure de l’acidité ou de l’alcalinité d’une solution aqueuse..
Le terme « pH » signifie « pondus hydrogenii » ou « le potentiel de l’hydrogène » et il a été introduit pour la première fois par le biochimiste danois, Soren Peter Lauritz Sorensen, en 1909.
Au cours de ses recherches, il a souvent eu besoin de mesurer le degré d’acidité de l’échantillon et a trouvé plus pratique d’écrire la concentration d’ions hydrogène sur l’échelle logarithmique décadique (par exemple, 0,0000001 mol/L H+ devient pH 7). Le pH a alors été défini comme [1] :

a = activité
c = concentration
H+ = ion hydrogène
La valeur du pH est ainsi mesurée sur une échelle logarithmique de 0 à 14, 7 étant neutre (Photo 1).
Lorsqu’une substance appelée acide est ajoutée à l’eau, elle augmente la concentration d’ions hydrogène et le pH tombe en dessous de 7. À l’inverse, une substance appelée base diminue la concentration en ions hydrogène et le pH monte au-dessus de 7. Cela signifie que chaque solution inférieure à pH 7 est acide et que chaque solution supérieure à 7 est alcaline. Puisque nous utilisons le logarithme décadique, 1 pH de moins signifie une augmentation de 10 fois de l’activité de H+. [2]

2. Comment fonctionne une électrode pH ?
Une électrode de verre ou une électrode de pH est un type d’électrode sélective d’ions – elle est sélective pour mesurer les ions hydrogène. Les pièces suivantes sont nécessaires pour la mesure potentiométrique du pH :
- électrode de référence, la plus courante est la demi-cellule de chlorure d’argent (fil d’argent recouvert d’AgCl en contact avec une solution saturée de KCl) – a un potentiel constant
- électrode indicatrice avec le verre sensible au pH – change de potentiel en réponse à la concentration de l’analyte,
- mV-mètre – lit la différence de potentiel entre l’électrode de référence et l’électrode indicatrice.
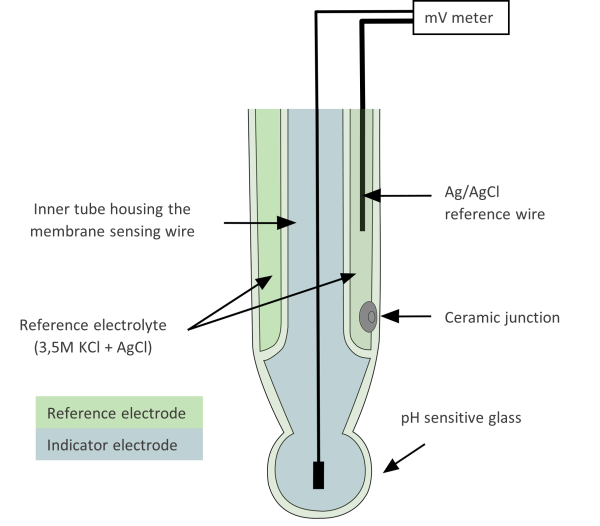
Habituellement, une électrode de pH combinée est utilisée (image 2), qui intègre à la fois l’électrode de référence et l’électrode indicatrice.
La partie de l’électrode qui est sensible au pH est la fine ampoule ou le cône de verre au bas de l’électrode indicatrice. À la surface de ce verre sensible se trouvent des atomes d’oxygène chargés négativement (de SiO4) qui peuvent lier des ions chargés positivement d’une taille appropriée – des ions hydrogène (ainsi que des ions alcalins mais avec moins de force).
Le nombre d’ions hydrogène liés à la surface du verre sensible dépend de l’activité (concentration) des ions hydrogène dans l’échantillon. Lorsque les ions hydrogène se lient au verre sensible au pH, un potentiel électrique est généré. Par conséquent, en lisant ce potentiel avec un mV-mètre, la valeur du pH peut être calculée à l’aide de l’équation de Nernst [2] :
E = potentiel en mV
E0 = potentiel électrique produit par l’électrode de référence
β = l’effet de la déshydratation, de la contamination, des rayures, etc. sur la membrane de verre
Un autre composant crucial d’une électrode est la jonction, qui permet le contact entre la solution dans l’électrode de référence (l’électrolyte, le KCl saturé) et l’échantillon. L’électrolyte fuit de l’électrode de référence dans l’échantillon, fermant le circuit électrique et rendant les mesures possibles. Plus le débit de l’électrolyte est important, meilleure est la réponse de l’électrode. [2]
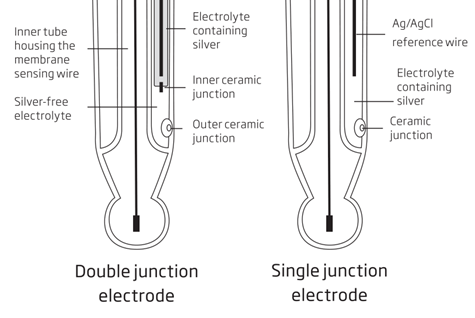
Les électrodes à jonction simple standard ont l’électrode de référence en contact direct avec l’échantillon (image 3). Le chlorure d’argent présent dans l’électrode de référence peut avoir une faible solubilité dans l’échantillon, ainsi lors de la prise de contact avec l’échantillon, des formes précipitées sur la face externe de la jonction entraînant des lectures dérivantes. Dans des conditions défavorables (haute pression, haute température, haute conductivité), le flux de l’électrolyte peut également être inversé, entraînant la contamination de la demi-cellule de référence et une défaillance complète de l’électrode.
Les électrodes à double jonction ont, comme leur nom l’indique, deux jonctions (image 3). Ces électrodes ont un compartiment supplémentaire pour l’électrode de référence avec la jonction interne. La zone intermédiaire est sans argent et insensible à la contamination, ce qui augmente la longévité de l’électrode.
Pourquoi les électrodes de pH doivent-elles être calibrées ?
Les valeurs E0 et β dans l’équation de Nernst dépendent de l’état de la membrane de verre (taux d’hydratation, dépôts, rayures…) et de la jonction (taux de colmatage).
Le calcul de ces valeurs serait impossible en pratique, et les changements sont trop importants pour les résultats. Après avoir calibré l’électrode de pH avec des solutions d’une valeur connue (de préférence avec au moins deux), les mesures sont ajustées en conséquence.
Pourquoi les électrodes de pH doivent-elles être entretenues ?
Il est important de comprendre que les ions hydrogène ne peuvent se lier à la membrane de verre que si elle est hydratée, c’est pourquoi l’électrode doit être stockée dans une solution de stockage HI70300 qui maintient la surface de l’électrode hydratée et prête pour les mesures (Image 4).

Les ions hydrogène ne peuvent pas non plus se lier à la surface s’il y a des dépôts (organiques ou inorganiques). La quantité de surface disponible pour le collage affecte la qualité des mesures.
Le nettoyage avec l’usage général HI7061 ou une solution de nettoyage spécifique à l’application éliminera les dépôts et restaurera l’électrode (image 5).

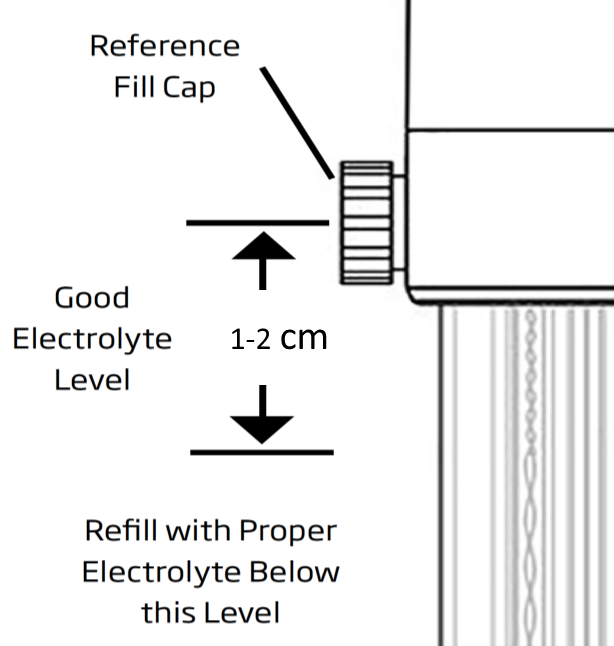
Le niveau de l’électrolyte dans l’électrode de référence doit être maintenu à 1-2 cm en dessous du trou de remplissage pour maintenir une pression appropriée pour la sortie d’électrolyte (Image 6).
Avant les mesures, les niveaux d’électrolyte doivent être vérifiés et remplis d’électrolyte HI7082 pour les électrodes à double jonction ou d’électrolyte HI7072 pour les électrodes à simple jonction si nécessaire. Et pendant les mesures, il est important que le bouchon soit desserré ou ouvert.
Comment vérifier l'état de l'électrode pH ?
Pour vérifier l’électrode, si elle est en bon état, le décalage et la pente doivent être déterminés.
Le décalage est la valeur mV mesurée dans une solution à pH 7,0. Théoriquement, cette valeur devrait être de 0 mV, mais en pratique un décalage de ±30 mV est acceptable.
La pente peut être déterminée en mesurant la valeur mV dans des solutions à pH 7,0 et pH 4,0 (ou pH 10,0) et en calculant la différence mV absolue.
D’après l’équation de Nernst, nous pouvons voir que cette différence devrait être de 59,16 mV * 3 (la différence de pH) = 177,48 mV, mais de 150 mV à 186 mV est une pente acceptable.
3. Mesure du pH d'échantillons difficiles
Lors de la mesure du pH avec une électrode de verre, nous pouvons rencontrer certaines difficultés. Tout d’abord, nous devons nous assurer que l’électrode a été correctement entretenue (nettoyée, hydratée, rechargée) et calibrée avec des tampons frais. Si les problèmes persistent, la conception de l’électrode n’est pas adaptée à la mesure du pH dans notre échantillon. Certains des problèmes les plus courants sont :
- lorsqu’il n’y a pas assez de débit d’électrolyte en raison des propriétés chimiques/physiques de l’échantillon ou du colmatage de la jonction,
- lorsque l’échantillon est semi-solide ou solide,
- lorsqu’il y a une concentration importante de sodium ou d’autres ions alcalins,
- si on a affaire à un échantillon avec HF,
- si nous mesurons des échantillonneurs à haute/basse température ou
- lorsqu’il y a du bruit dans l’environnement.
Hanna Instruments propose des solutions à tous ces problèmes avec des jonctions, des embouts, des types de verre et des conceptions de corps spéciaux.
3.1. Faible débit d'électrolyte
Exemples:
- échantillons à faible conductivité (par exemple, eau potable, échantillons avec moins de 100 μS/cm)
- échantillons à conductivité élevée (par exemple, saumures, eau de mer, acides forts, bases fortes)
- échantillons visqueux (par exemple, peinture, cosmétiques, pâtes, émulsions)
Avoir un flux d’électrolyte suffisant de l’électrode de référence dans l’échantillon à travers la jonction est crucial pour recevoir des lectures stables.
Dans les cas où l’électrolyte de référence et l’échantillon diffèrent fortement en composition, ce flux est limité et un phénomène appelé potentiel de jonction a un effet significatif sur les mesures.
Les électrodes standard ont une jonction en céramique qui ne fournit pas un flux d’électrolyte suffisant lorsque le pH d’échantillons à faible conductivité, d’échantillons à conductivité élevée ou d’échantillons visqueux est mesuré. En utilisant des électrodes à multiples jonctions céramiques, le débit est augmenté et les lectures stabilisées.
L’électrode de pH à double jonction Hanna Instruments HI10530 avec une triple jonction en céramique sur la jonction externe (image 7) est conçue pour des mesures de pH fiables dans des échantillons à faible conductivité et visqueux, avec un débit d’électrolyte de 40 à 50 µL/heure (contre 15 à 20 µL/heure pour une électrode standard).
De plus, le type de verre à basse température avec une impédance plus faible améliore la qualité des mesures de pH dans de tels échantillons.
L’électrode de pH à double jonction Hanna Instruments HI10430 avec double jonction céramique (Image 8) est idéale pour les applications impliquant des échantillons à haute conductivité ou des échantillons concentrés, ayant un débit d’électrolyte de 30 à 40 µL/heure.
Le système à double jonction protège également l’électrode de référence de la contamination.
3.2. Jonction bouchée
Exemples:
- échantillons « sales » riches en solides (par exemple, vin, jus, purée, moût)
- gras
- teneur en protéines (p. ex. lait, viande, fromage et autres échantillons d’aliments)
Comme discuté précédemment, l’électrolyte qui fuit de l’électrode de référence dans les échantillons ferme le circuit électrique et rend les mesures possibles. Tout colmatage de la jonction entraînera des lectures erratiques et instables.
« Les échantillons « sales » qui ont une teneur élevée en solides, graisses, protéines, etc. peuvent rapidement obstruer les jonctions céramiques conventionnelles et rendre l’électrode inutilisable.
Le choix d’une électrode avec une conception de jonction spéciale qui résiste au colmatage (par exemple, système de prévention du colmatage, jonction en tissu ou jonction ouverte) prolonge la longévité de l’électrode.
L’électrode de pH Hanna Instruments HI1048 est dotée de la technologie Clogging Prevention System (CPS) (Image 9) et est conçue pour l’analyse du pH du vin, du moût et du jus.
La technologie CPS utilise la porosité du verre dépoli couplée à un manchon en PTFE pour éviter le colmatage de la jonction.
Le verre dépoli permet le bon écoulement du liquide, tandis que le manchon en PTFE repousse les solides.
Une autre conception de jonction adaptée à la mesure du pH d’échantillons à forte teneur en sols est la jonction en tissu rétractable.
Dans ce cas, la jonction peut être dégagée en extrayant simplement env. 3 mm de la jonction.
L’électrode de pH Hanna Instruments FC214 (image 10) présente la jonction en tissu et est idéale pour l’analyse de la purée et du moût dans le processus de fabrication de la bière.
Les électrodes de pH de la série Hanna Instruments Foodcare présentent la conception à jonction ouverte.
Dans ce type de jonction, où une interface de gel solide (viscolène) se trouve entre l’échantillon et la référence interne Ag/AgCl.
Cette interface le rend imperméable au colmatage, ce qui se traduit par une réponse rapide et des lectures stables.
De plus, ce type de jonction empêche les contaminations des échantillons, ce qui est crucial lors du test des aliments.
3.3. Échantillons solides et semi-solides
Exemples:
- échantillons semi-solides (par exemple, yogourt, fromage, viande, crèmes, échantillons de sol)
- échantillons solides (p. ex. peau, cuir, plaques de gélose, papier)
Les électrodes de pH de forme sphérique conventionnelles ont été conçues pour les échantillons aqueux car elles offrent une grande surface pour l’interaction avec l’échantillon.
Avec ce type de forme de pointe, il est cependant difficile de pénétrer dans des échantillons semi-solides ou d’entrer en contact avec des échantillons solides. Des électrodes à pointes coniques ou plates permettent une mesure directe.
Le test d’échantillons semi-solides a été simplifié grâce aux électrodes à pointe conique. Ce type de conception de pointe permet la pénétration et la mesure directe du pH dans des échantillons tels que le yaourt, le fromage, la viande, les crèmes, le sol, etc.
Hanna Instruments propose une grande variété d'électrodes de forme conique conçues pour des échantillons spécifiques (Image 11).





Photo 11 : Électrodes Hanna Instruments
Dans le cas d’échantillons solides, lorsque la pénétration dans l’échantillon n’est pas possible, le contact de surface doit être optimisé à l’aide d’une électrode de forme plate.
L’électrode Hanna Instruments HI1414 avec une pointe plate (image 12) est conçue pour les mesures de surface du pH sur la peau, le cuir, les plaques de gélose, le papier, etc.
3.4. Échantillons à pH élevé
Exemples:
- échantillons dont le pH est supérieur à 12 (par exemple, détergents, eau savonneuse, nettoyants ménagers, bases fortes)
Le verre sensible au pH n’est pas strictement sélectif pour les ions hydrogène.
Les ions alcalins, en particulier les ions sodium, peuvent également se lier à la surface du verre, mais avec moins de force et, dans la plupart des cas, n’ont pas d’effet significatif sur les mesures de pH.
Dans les échantillons à pH élevé, la concentration d’ions hydrogène est très faible par rapport à la concentration d’ions alcalins et la quantité d’ions alcalins liés à la surface du verre modifie considérablement le potentiel de lecture.
La valeur de pH affichée est donc inférieure à ce qu’elle est réellement. La différence entre les valeurs théoriques et mesurées est appelée erreur alcaline.
Le verre haute température de Hanna Instruments minimise l’erreur alcaline dans les solutions fortement alcalines.
À pH 13 dans une solution avec une concentration de sodium de 1,0 M, l’erreur alcaline pour un verre à haute température est de 0,15 pH, par rapport à 0,43 pH pour un verre à usage général et à plus de 0,79 pH pour un verre à basse température.
3.5. Échantillons avec de l'acide fluorhydrique
Exemples:
- réactifs de laboratoire et étalons analytiques contenant du fluorure
L’acide fluorhydrique peut dissoudre rapidement le verre. L’électrode Hanna Instruments HI1143 utilise du verre résistant au HF pour les applications agressives qui incluent des ions fluorure (jusqu’à 2 g/L).
Les électrodes fabriquées avec ce verre durent dix fois plus longtemps que les électrodes fabriquées avec des formulations de verre à pH standard (de 10 à 100 jours). De plus, la conception à double jonction protège la contamination de l’électrode de référence.
3.6. Échantillons haute/basse température
Exemples:
- nourriture refroidie
- pasteurisation
- faire bouillir le moût
A basse température, les électrodes avec un verre à haute impédance donneront à basse température des signaux très bruyants et erratiques. Les électrodes Hanna Instruments avec verre BASSE température ont une faible impédance et permettent des mesures stables à des températures plus basses.
À des températures élevées, cependant, le verre peut se dissoudre facilement, ce qui réduit la durée de vie et les performances de l’électrode. Les électrodes Hanna Instruments avec verre HAUTE température sont conçues pour une utilisation prolongée à des températures élevées. Avec un verre à haute résistance, les mesures à des températures élevées sont précises avec d’excellents temps de réponse.
3.7. Échantillons avec courants électriques
Exemples:
- bains galvaniques
- tours de refroidissement
- chaudières
- piscines
Les courants électriques dans l’échantillon peuvent affecter la tension de référence de la demi-cellule qui est connectée via la jonction liquide avec l’échantillon. Dans ce cas, l’électrode de référence capte les champs électromagnétiques et la mesure du pH est altérée.
Une broche d’adaptation est une technique de mesure différentielle utilisée pour éliminer les boucles de masse et les perturbations de mode commun pour un système de mesure, isolant ainsi les champs de courant/magnétiques de l’électrode de référence. Hanna fabrique un certain nombre de modèles avec la conception de broche correspondante pour des mesures de pH précises et sûres.
Ce problème peut également être résolu en utilisant des électrodes à corps en titane (image 13). La cage en titane agit comme une cage de Faraday et protège la partie interne de l’électrode du bruit extérieur.
Vous ne savez pas quelle électrode serait la meilleure pour votre échantillon ?
Contactez un spécialiste technique Hanna à [email protected] ou en utilisant notre formulaire de contact.
LES RÉFÉRENCES:
- Jensen, William B. (2004). « Le symbole du pH » (PDF) . Journal d’éducation chimique .
- Harris C. Daniel (2010). Analyse chimique quantitative, 8e édition. H. Freeman and Company, New York

Avec un excellent produit
Venez de grands résultats








